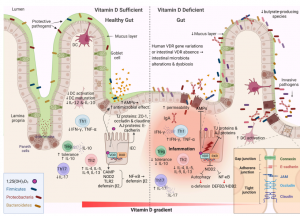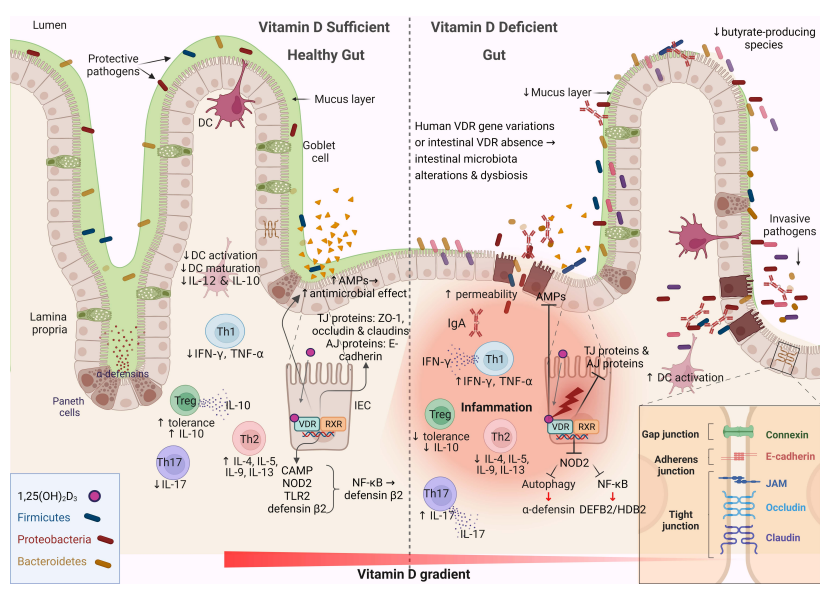
Représentation schématique des changements associés à la barrière intestinale entre une quantité suffisante de vitamine D et une vitamine
Intestin dysbiotique déficient en D.
La signalisation de la vitamine D joue un rôle essentiel dans le maintien de l’homéostasie intestinale.
La vitamine D contribue à l’activation et à la synthèse des récepteurs de reconnaissance de formes, de diverses cytokines et des peptides antimicrobiens (AMP).
Le tissu lymphoïde (tissu contenant les cellules du système immunitaire) associé à l’intestin est impliqué dans l’immunité adaptative et innée et se compose de cellules B, de cellules T, de macrophages et de cellules dendritiques, qui y contribuent.
Ce tissu joue également un rôle important dans la modulation du microbiote intestinal, en empêchant la prolifération bactérienne et en renforçant l’intégrité de la barrière intestinale.
Des modifications sont induites par la vitamine D dans la composition du microbiome, principalement par l’induction d’un microbiote favorable à la santé et la réduction du ratio Firmicutes/Bacteroides.
📌En résumé, la vitamine D affecte positivement les tissus intestinaux en favorisant les réponses immunitaires innées et en atténuant l’immunité adaptative inflammatoire médiée par les lymphocytes T, fonctions étroitement associées au développement de l’auto-immunité.
Vitamine D et muqueuse de la barrière intestinale : La muqueuse intestinale sert à la fois de barrière physique et fonctionnelle séparant les cellules hôtes du microenvironnement. Il se compose de plusieurs composants qui travaillent ensemble pour remplir sa fonction, tels que le microbiote intestinal commensal, une couche de mucus externe, l’immunoglobuline A sécrétoire et les AMP sécrétés dans la couche de mucus en tant que molécules de détection immunitaire et protéines régulatrices. La couche de cellules épithéliales spécialisées et la lamina propria interne contribuent également à cette fonction. Les cellules épithéliales de l’intestin forment une monocouche et sont étroitement reliés par des structures symétriques appelées complexes jonctionnels. Les jonctions serrées (TJ pour tights junctions) sont situées du côté apical des cellules et sont responsables du transport des ions et de la régulation des petites molécules. Le tissu lymphoïde associé à l’intestin est impliqué dans l’immunité adaptative et innée et se compose de cellules B, de cellules T, de macrophages et de cellules dendritiques, qui contribuent de manière essentielle aux mécanismes de défense immunologiques de la barrière intestinale. La signalisation vitamine D-VDR aide à maintenir l’intégrité de la barrière intestinale en régulant la chaîne légère de la myosine kinase et offre une protection en empêchant l’amplificateur de chaîne légère du facteur nucléaire kappa des cellules B activées (NF-κb) par la stimulation MLCK médiée
Le rôle des bactéries dans le métabolisme de la vitamine D : Il existe de plus en plus de preuves selon lesquelles les bactéries jouent un rôle important dans la modification du métabolisme de la vitamine D. Plusieurs enzymes exprimées par les bactéries sont impliquées dans l’hydroxylation des stéroïdes ; par conséquent, ces enzymes peuvent induire la vitamine D de la même manière que chez l’homme.
Influence du microbiome intestinal sur les réponses immunitaires et l’auto-immunité : l’étendue de la dysbiose peut varier selon les maladies auto-immunes. Il existe des preuves que certaines bactéries peuvent favoriser ou inhiber les réponses immunitaires de différentes manières, ce qui suggère que le microbiote peut avoir une influence multiforme sur les maladies inflammatoire
Pour aller plus loin:
Nous le savons, la vitamine D subit dans le foie une conversion vers sa forme biologiquelment active. mais il a été montré que des bactéries du microbiote en étaient capables aussi.
Par exemple, la bactérie CYP105A1 (Streptomyces griseolus) est responsable de la conversion de la vitamine D, en forme biologiquement active de vitamine D par deux hydroxylations successifs. Cela suggère que la fonction bactérienne correspond aux enzymes CYP27A1, CYP27B1 et CYP2R1 associées à la vitamine D.
Les chercheurs ont démontré l’existence de protéines homologues du CYP27A1 et du CYP27B1 dans les populations bactériennes, et en particulier, chez les torques Ruminococcus du phylum Firmicutes et chez Mycobacterium tuberculosis. Ils se sont manifestés dans le foie en présence d’une cyclodextrine utilisant un mélange contenant un micro-organisme capable d’hydroxyler les composés de la vitamine D ou une enzyme produite par un micro-organisme.
L’administration de suppléments de vitamine D à forte dose a entraîné des modifications du microbiome intestinal chez des adolescentes ; plus précisément, une dose hebdomadaire de 50 000 UI de cholécalciférol (Vitamine non active)sur une période de 9 semaines a entraîné une diminution des populations de Bacteroidetes et de Lactobacillus et une augmentation des populations de Firmicutes et de Bifidobacterium.
En parallèle, la supplémentation en vitamine D a provoqué des changements significatifs chez Bacteroides et Prevotella, qui ont montré une variation des entérotypes (Un entérotype est un groupe de composition bactérienne intestinale spécifique chez l’humain).
L’administrationde vitamine D, durant 8 semaines , a entraîné une diminution des Protéobactéries (notamment les Gamma Protéobactéries) et une augmentation des concentrations de Bacteroidetes dans le tractus gastro-intestinal supérieur. Des changements à des niveaux taxonomiques inférieurs ont également été observés ; en particulier, une proportion plus élevée du genre Lachnospira et une proportion plus faible du genre Blautia ont été trouvées dans le microbiote fécal.
Une étude a montré que les enfants présentant une carence en vitamine D présentaient une concentration plus élevée du genre Prevotella que des Bacteroides dans l’intestin.
Limites :
Les recherches futures devraient se concentrer sur l’élucidation des mécanismes impliqués dans les changements dans la composition du microbiote intestinal associés au statut ou à la supplémentation en vitamine D et/ou à une déficience génétique de l’expression/activité du VDR. Il existe donc un grand besoin d’études animales et humaines bien conçues permettant des analyses cohérentes du microbiote intestinal et une évaluation de la vitamine D ou VDR. En outre, la question de savoir quelle dose de supplémentation en vitamine D entraîne des changements spécifiques dans le microbiome intestinal qui affectent la santé de l’hôte reste en suspens. Étant donné que le microbiome intestinal peut fournir des informations précieuses pour évaluer les réponses individuelles à une supplémentation en vitamine D, les recherches futures devraient se concentrer sur la variabilité intra- et inter-individuelle à l’aide de stratégies multi-omiques. En parallèle, la conception d’études expérimentales sur les animaux est nécessaire pour comprendre la causalité, car il est possible que des changements microbiens précèdent l’apparition de la maladie, suggérant une relation causale potentielle ou une réponse passive à la maladie.
Référence :
Exploring the Role of Vitamin D and the Vitamin D Receptor in the Composition of the Gut Microbiota. Aggeletopoulou I. et al. Front. Biosci. (Landmark Ed) 2023; 28(6): 116